Un paso de gigante en el tratamiento del Alzheimer: la EMA autoriza Leqembi (lecanemab) para etapas tempranas
El comunicado recibido el 14 de noviembre convirtió a esa fecha en un día histórico si hablamos de Alzheimer: “Tras reexaminar su dictamen inicial, el Comité de Medicamentos Humanos (CHMP) de la EMA ha recomendado conceder una autorización de comercialización a Leqembi (lecanemab) para el tratamiento del deterioro cognitivo leve (problemas de memoria y pensamiento) o la demencia leve debida a la enfermedad de Alzheimer (enfermedad de Alzheimer temprana) en pacientes que tienen solo una o ninguna copia de ApoE4 , una determinada forma del gen de la proteína apolipoproteína E”. Hay que recordar que en julio, el comité había emitido un dictamen negativo sobre el uso de Leqembi en una población más amplia de todos los pacientes con enfermedad de Alzheimer en fase inicial. Pero, se sabía que era cuestión de tiempo cuando este verano la Administración estadounidense de Alimentos y Medicamentos (FDA) había dado su visto bueno.
El cambio de idea de la CHMP sobre el uso del Legembi deriva de un nuevo estudio que concluyó que los beneficios de este medicamento para ralentizar la progresión de los síntomas de la enfermedad son mayores que sus riesgos.
En todo caso, el dictamen del CHMP es un paso intermedio en el camino de Leqembi hacia el acceso de los pacientes. El dictamen se enviará ahora a la Comisión Europea para que adopte una decisión sobre una autorización de comercialización a escala de la UE. Una vez que se haya concedido una autorización de comercialización, las decisiones sobre el precio y el reembolso se adoptarán a nivel de cada Estado miembro, teniendo en cuenta el papel y el uso potenciales de este medicamento en el contexto de su sistema sanitario nacional.
SOLO PARA ALGUNOS PACIENTES
Los pacientes objetivo de esta indicación –con una sola copia de ApoE4 o sin ella– tienen menos probabilidades de experimentar anomalías en las imágenes relacionadas con amiloide (ARIA) que las personas con dos copias de ApoE4. ARIA es un efecto secundario grave reconocido de Leqembi que implica hinchazón y posible sangrado en el cerebro.
La ARIA se manifiesta de dos formas: ARIA-E (edema), que consiste en la acumulación de líquido en el cerebro, y ARIA-H (hemorragia), que consiste en pequeñas hemorragias en el cerebro. Puede presentarse de forma natural en todos los pacientes con enfermedad de Alzheimer, pero se ve exacerbada por la toma de medicamentos como Leqembi, es decir, anticuerpos dirigidos contra la beta amiloide. En el nuevo examen solicitado por la empresa, el CHMP tuvo en cuenta los análisis de subgrupos que excluyeron los datos de los pacientes que portaban dos copias del gen ApoE4 y, por tanto, presentaban el mayor riesgo de ARIA.
Los resultados de estos análisis mostraron que entre los pacientes tratados con Leqembi, el 8,9% de aquellos con solo una copia o ninguna copia de ApoE4 experimentaron ARIA-E, en comparación con el 12,6% de todos los pacientes; de manera similar, el 12,9% de los pacientes de la población restringida experimentaron ARIA-H en comparación con el 16,9% de la población más amplia. Entre los pacientes tratados con placebo (un tratamiento ficticio), las cifras fueron del 1,3% y del 6,8% para ARIA-E y ARIA-H, respectivamente, en la población restringida.
EFICACIA
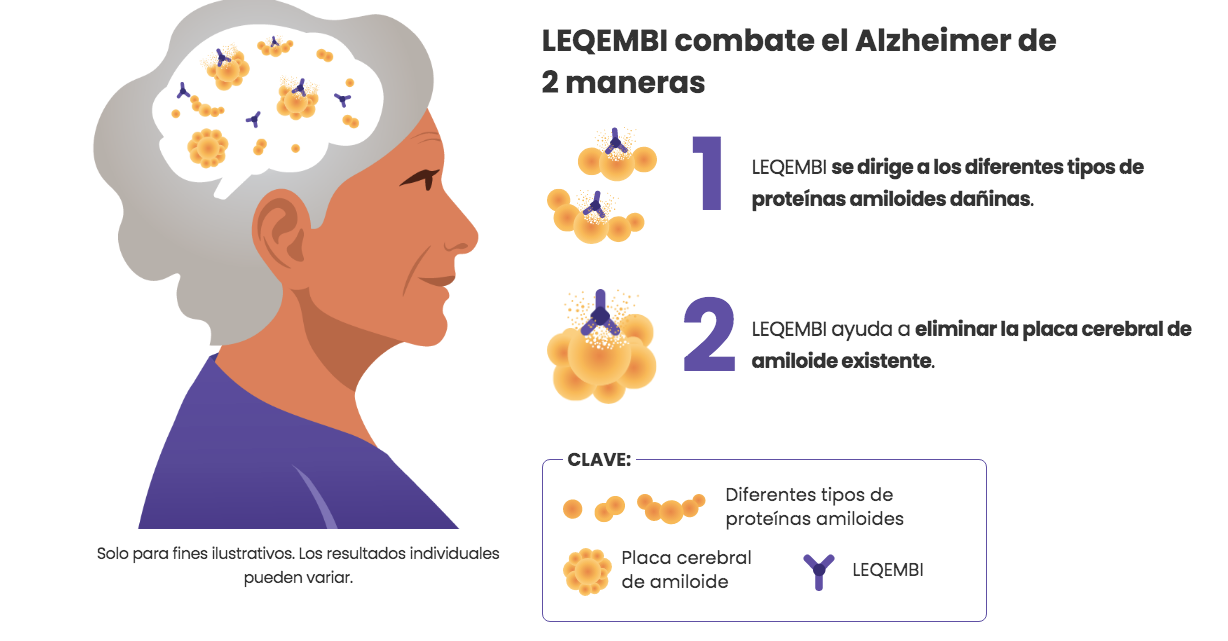
Leqembi contiene el principio activo lecanemab y se administra en forma de infusión (goteo) en una vena una vez cada dos semanas. El principio activo de Leqembi, lecanemab, es un anticuerpo monoclonal (un tipo de proteína) que se adhiere a una sustancia llamada beta amiloide, que forma placas en el cerebro de los pacientes con enfermedad de Alzheimer. Al unirse a la beta amiloide, Leqembi reduce las placas amiloides en el cerebro. Los efectos secundarios más frecuentes de Leqembi incluyen reacciones relacionadas con la infusión, ARIA-H, ARIA-E y dolor de cabeza. Leqembi no debe ser utilizado por personas que reciben tratamiento anticoagulante, ya que esto podría aumentar el riesgo de desarrollar ARIA-H y hemorragias cerebrales.
En términos de eficacia, el comunicado de la EMA señala que los beneficios de Leqembi en la población restringida están en línea con los observados en la población más amplia. Para el reexamen, la empresa proporcionó un análisis de subgrupos de datos del estudio principal que incluyó a 1.521 pacientes que tienen una o ninguna copia de ApoE4 de un total de 1.795 pacientes. La principal medida de eficacia fue un cambio en los síntomas cognitivos y funcionales después de 18 meses, medido utilizando una escala de calificación de demencia conocida como CDR-SB. La escala va de 0 a 18, donde las puntuaciones más altas indican un mayor deterioro.
Después de 18 meses de tratamiento, los pacientes tratados con Leqembi tuvieron un aumento menor en la puntuación CDR-SB que los que recibieron placebo (1,22 frente a 1,75), lo que indica un deterioro cognitivo más lento. Los resultados de otras medidas clave fueron similares a los observados con la escala CDR-SB.
MEDIDAS PARA SU SEGURIDAD
El CHMP concluyó que los beneficios de Leqembi superan los riesgos en pacientes con deterioro cognitivo leve o demencia leve debido a la enfermedad de Alzheimer con una o ninguna copia de ApoE4, siempre que se adopten medidas de minimización de riesgos para reducir el riesgo de ARIA grave y sintomática y controlar sus consecuencias a largo plazo.
Leqembi estará disponible a través de un programa de acceso controlado para garantizar que el medicamento solo se utilice en la población de pacientes recomendada. Los pacientes deberán realizarse resonancias magnéticas para controlar la presencia de ARIA antes de iniciar el tratamiento y antes de la 5.ª , 7.ª y 14.ª dosis de Leqembi. Es posible que se necesiten resonancias magnéticas adicionales en cualquier momento durante el tratamiento si los pacientes presentan síntomas de ARIA (como dolor de cabeza, confusión, cambios visuales, mareos, náuseas y dificultad para caminar).
Para aumentar la concienciación sobre el ARIA y garantizar su detección y tratamiento precoces, la empresa proporcionará una guía y una lista de comprobación para los profesionales sanitarios, una tarjeta de alerta para los pacientes y programas de formación sobre el ARIA para los profesionales sanitarios. Además, deberá llevar a cabo un estudio de seguridad posterior a la autorización para caracterizar mejor el ARIA-E y el ARIA-H y evaluar la eficacia de las medidas de minimización de riesgos.
Al igual que con todas las evaluaciones, durante el nuevo examen el CHMP también consideró las presentaciones de pacientes, cuidadores, médicos y organizaciones, que compartieron sus perspectivas sobre las necesidades no satisfechas de los pacientes con enfermedad de Alzheimer y los datos sobre el deterioro cognitivo y los riesgos.
REACCIONES AL COMUNICADO
Desde Ace Alzheimer Center Barcelona hacen una valoración “muy positiva” sobre la reciente aprobación de Leqembi. “La decisión de la EMA marca un antes y un después: abre una ventana de esperanza para pacientes y familias que conviven con el Alzheimer y subraya el valor de la ciencia y la innovación en la búsqueda de soluciones. Es un paso que no solo simboliza progreso, sino también compromiso con la mejora de la calidad de vida de quienes enfrentan esta realidad”. Para Miren Jone Gurrutxaga, directora general de este centro, “este logro llega después de años de investigación y colaboración científica y sanitaria. Estamos muy orgullosos de haber participado en este éxito a través del ensayo clínico que nos ha hecho expertos en el manejo del fármaco y que nos ha permitido estar preparados para cuando podamos administrarlo en España”.
Por su parte, desde la Sociedad Española de Neurología (SEN) también se muestran congratulados por este anuncio. Para Raquel Sánchez del Valle, coordinadora del Grupo de Estudio de Conducta y Demencias de la entidad, “teniendo en cuenta que julio de 2024 la EMA recomendó inicialmente que no se aprobase en la Unión Europea la comercialización del lecanemab, en la SEN nos congratulamos enormemente de que la EMA haya reconsiderado su recomendación. Se trata de una decisión que, en este caso, se aproxima a la de otras agencias reguladoras y comités asesores y que permitirá a los pacientes europeos poder tener acceso a los mismos tratamientos que los pacientes de otros países como Estados Unidos, Reino Unido, Japón, China, Arabia Saudita, Israel, etcétera”. En este sentido, Jesús Porta-Etessam, presidente de la SEN, subraya que “aunque estos medicamentos no permiten parar totalmente la progresión de la enfermedad, los resultados son modestos y no están exentos de efectos secundarios, es absolutamente fundamental que –aunque con las restricciones pertinentes–, los pacientes europeos tengan acceso a los mismos tratamientos a los que pueden acceder otros pacientes de países de nuestro entorno”.
Finalmente, “desde CEAFA consideramos una muy buena noticia la rectificación de la EMA y nos congratulamos con las personas con Alzheimer que van a disponer de una nueva herramienta terapéutica tras más de 20 años de espera”. Así se manifestó la Confederación Española de Alzheimer, pero que añade que se trata de “un primer paso, importante, pero queda todavía otro que no debemos olvidar: la aprobación por para de la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) y la inclusión del tratamiento en la cartera de servicios del Sistema Nacional de Salud. Esta será la tarea que, a partir de ahora, asumirá CEAFA para que todas las personas que cumplan con los criterios clínicos puedan acceder al tratamiento en igualdad de condiciones en todo el estado”. Con este fin, también el Grupo de Estudio de Conducta y Demencias de la Sociedad Española de Neurología anuncia que, próximamente, realizará unas recomendaciones sobre los criterios a tener en cuenta para el buen uso de éste u otros fármacos similares.
